Geïmmobiliseerde CALB
CALB wordt geïmmobiliseerd door fysieke adsorptie op de zeer hydrofobe hars die een macroporeus styreen/methacrylaatpolymeer is.Geïmmobiliseerde CALB is geschikt voor toepassingen in organische oplosmiddelen en oplosmiddelvrije systemen en kan onder geschikte omstandigheden langdurig worden gerecycled en hergebruikt.
Productcode: SZ-CALB-IMMO100A, SZ-CALB-IMMO100B.
★Hogere activiteit, hogere chirale selectiviteit en hogere stabiliteit.
★Betere prestaties in de niet-waterige fasen.
★ Verwijder eenvoudig uit het reactiesysteem, beëindig reacties snel en vermijd eiwitresten in het product.
★Kan worden gerecycled en hergebruikt om de kosten te verlagen.
| Werkzaamheid | ≥10000PLU/g |
| pH-bereik voor reactie | 5-9 |
| Temperatuurbereik voor reactie | 10-60℃ |
| Uiterlijk | CALB-IMMO100-A: Lichtgele tot bruine vaste stof CALB-IMMO100-B: Witte tot lichtbruine vaste stof |
| Deeltjesgrootte | 300-500μm |
| Verlies bij drogen bij 105℃ | 0,5% -3,0% |
| Hars voor immobilisatie | Macroporeus, styreen/methacrylaatpolymeer |
| reactie oplosmiddel | Water, organisch oplosmiddel, enz., of zonder oplosmiddel.Voor de reactie in sommige organische oplosmiddelen kan 3% water worden toegevoegd om het reactie-effect te verbeteren |
| Deeltjesgrootte | CALB-IMMO100-A: 200-800 m CALB-IMMO100-B: 400-1200 m |
Eenheidsdefinitie: 1 eenheid komt overeen met de synthese van 1μmol per minuut propyllauraat uit laurinezuur en 1-propanol bij 60℃.De bovenstaande CALB-IMMP100-A en CALB-IMMO100-B komen overeen met geïmmobiliseerde dragers met verschillende deeltjesgroottes.
1. Reactortype:
Het geïmmobiliseerde enzym is toepasbaar op zowel een ketelbatchreactor als een vast bed continue stroomreactor.Er moet op worden gelet dat beknelling als gevolg van externe kracht tijdens het voeren of vullen wordt vermeden.
2. Reactie pH, temperatuur en oplosmiddel
Het geïmmobiliseerde enzym moet als laatste worden toegevoegd, nadat andere materialen zijn toegevoegd en opgelost, en de pH moet worden aangepast.
Als het verbruik van substraat of de vorming van product zal leiden tot een verandering van de pH tijdens de reactie, moet er voldoende buffer aan het reactiesysteem worden toegevoegd, of de pH moet tijdens de reactie worden gecontroleerd en aangepast.
Binnen het temperatuurtolerantiebereik van CALB (onder 60 ) nam de conversieratio toe met de temperatuurstijging.In praktisch gebruik moet de reactietemperatuur worden gekozen in overeenstemming met de stabiliteit van het substraat of product.
In het algemeen is de esterhydrolysereactie geschikt in een waterige fasesysteem, terwijl de estersynthesereactie geschikt is in een organische fasesysteem.Het organische oplosmiddel kan ethanol, tetrahydrofuran, n-hexaan, n-heptaan en tolueen zijn, of een geschikt gemengd oplosmiddel.Voor de reactie in sommige organische oplosmiddelen kan 3% water worden toegevoegd om het reactie-effect te verbeteren.
3. Hergebruik en levensduur van CALB
Onder de juiste reactieconditie kan CALB worden teruggewonnen en hergebruikt, en de specifieke applicatietijden variëren met verschillende projecten.
Als de teruggewonnen CALB niet continu wordt hergebruikt en na terugwinning moet worden opgeslagen, moet deze worden gewassen en gedroogd en verzegeld bij 2-8 ℃.
Als de reactie-efficiëntie na een aantal hergebruikrondes enigszins is verminderd, kan CALB op de juiste manier worden toegevoegd en verder worden gebruikt.Als de reactie-efficiëntie ernstig wordt verminderd, moet deze worden vervangen.
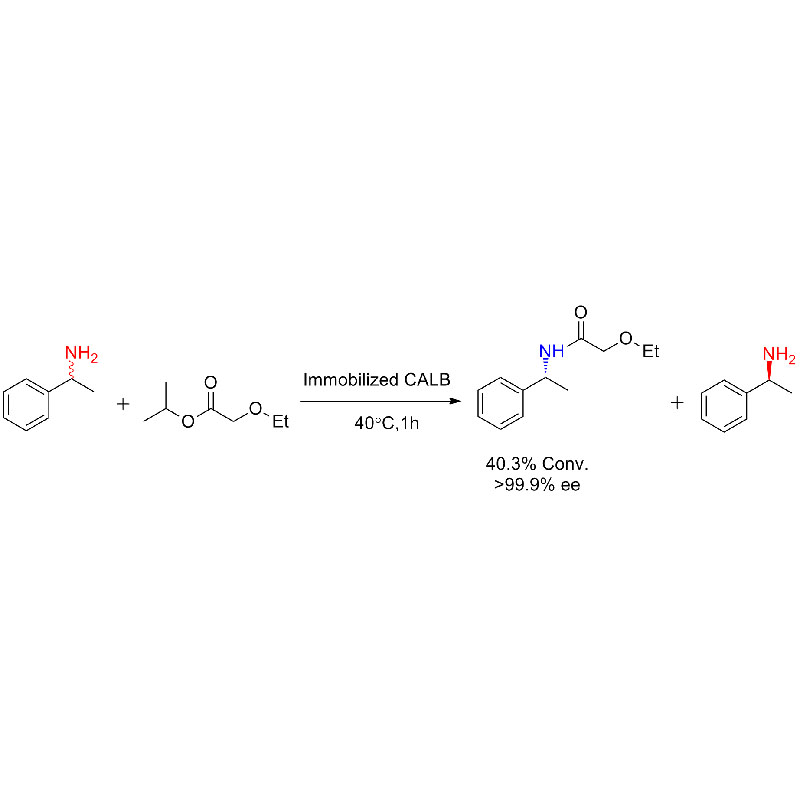
Voorbeeld 1 (Aminolyse)(1):
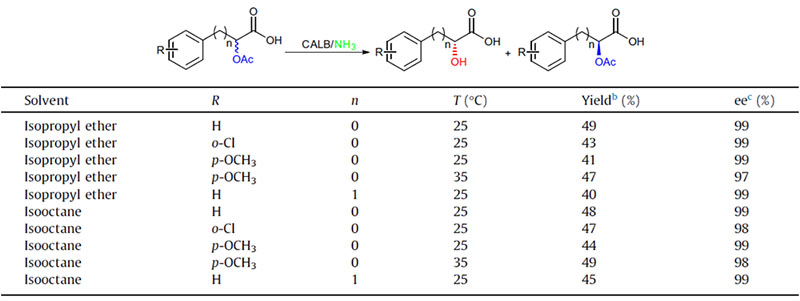
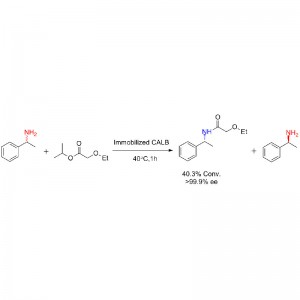
Voorbeeld 2 (Aminolyse)(2):
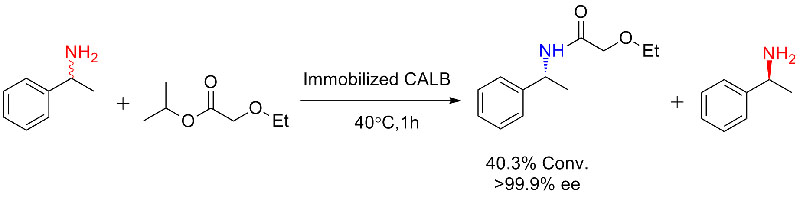
Voorbeeld 3 (Ringopening polyestersynthese)(3):
Voorbeeld 4 (transesterificatie, regioselectief van hydroxylgroep)(4):
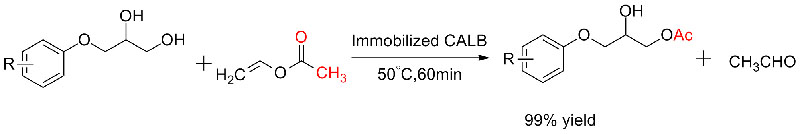
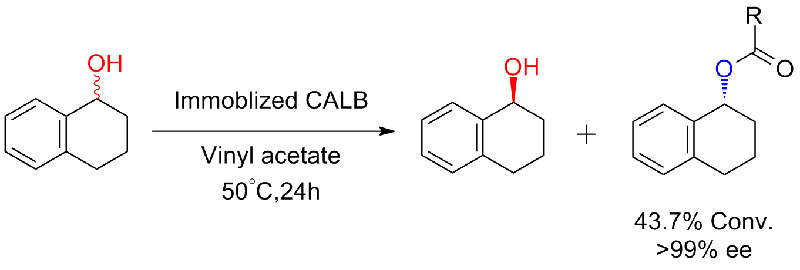
Voorbeeld 5 (transesterificatie, kinetische resolutie van racemische alcoholen)(5):
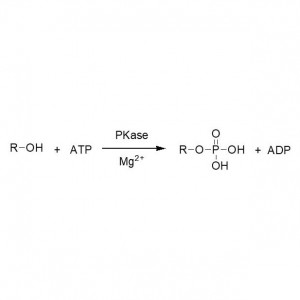
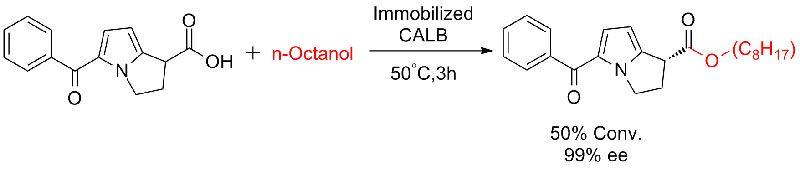
Voorbeeld 6 (verestering, kinetische resolutie van carbonzuur)(6):
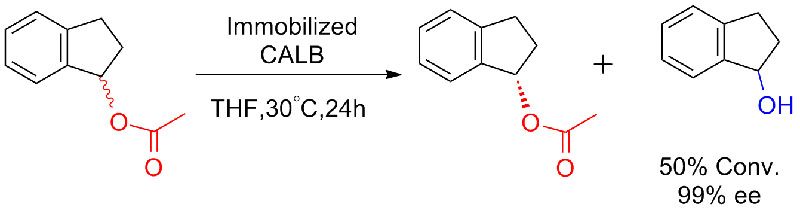
Voorbeeld 7 (esterolyse, kinetische resolutie)(7):
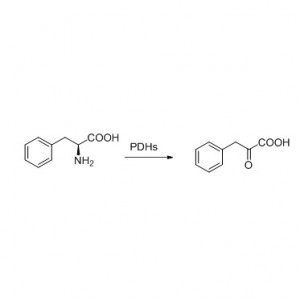
Voorbeeld 8 (Hydrolyse van amiden)(8):
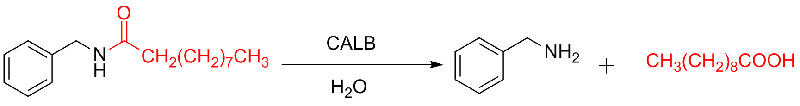
Voorbeeld 9 (Acylering van aminen)(9):
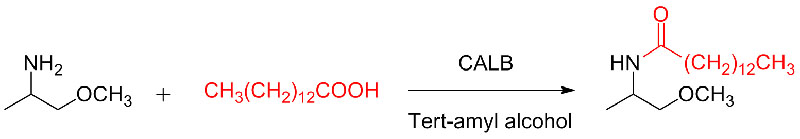

Voorbeeld 10 (Aza-Michael-additiereactie)(10):
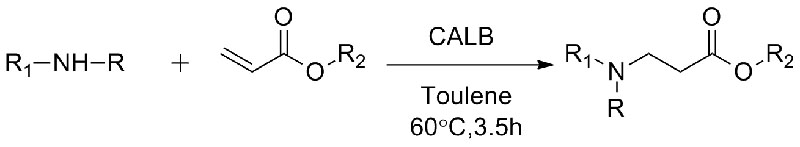
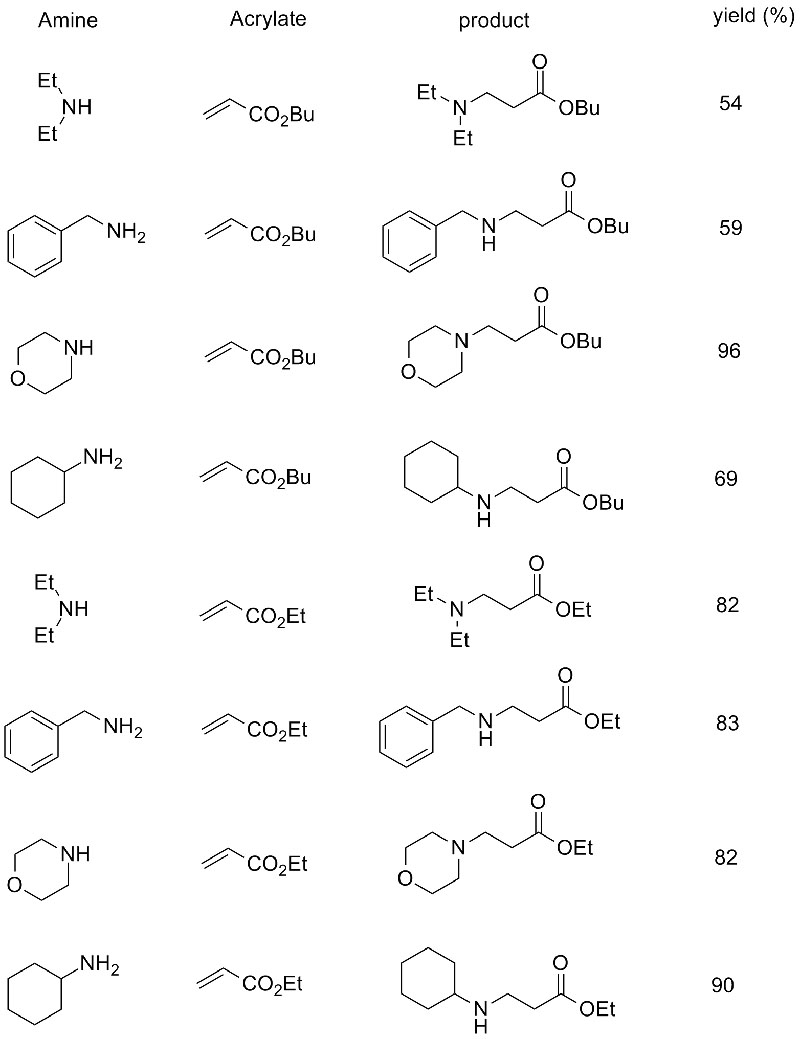
1. Chen S, Liu F, Zhang K, et al.Tetraëder Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, et al.Tetraëder, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, et al.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind. Eng.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Katal.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav GD. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA, et al.J. Mol.Katal.B: Enzym, 2016, 130: 58-69.
8. Gavil'an AT, Castillo E, L'opez-Mungu'AJ Mol.Katal.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, et al.J. Mol.Katal.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, et al.Tetraëder Lett, 2010, 51: 4455-4458.